یک کنکور
نمونه تست کنکور امسال سالهای قبل تست ریاضی فیزیک شیمی زیان ادبیات جزوه حل امسائل انگلیسی گاج آیندگان دبیرستان پیش دانشگاهییک کنکور
نمونه تست کنکور امسال سالهای قبل تست ریاضی فیزیک شیمی زیان ادبیات جزوه حل امسائل انگلیسی گاج آیندگان دبیرستان پیش دانشگاهیدانلود جزوه شیمی پیش دانشگاهی , مبحث اسید و باز و الکترو شیمی جزوات کنکوری و نکات تستی شیمی
مبحث اسید و باز و الکترو شیمی,جزوات کنکوری و نکات تستی شیمی,دانلود جزوه شیمی پیش دانشگاهی
دانلود جزوه شیمی پیش دانشگاهی , مبحث اسید و باز و الکترو شیمی جزوات کنکوری و نکات تستی شیمی
دانلود جزوه شیمی پیش دانشگاهی , مبحث اسید و باز و الکترو شیمی
دانلود جزوه شیمی پیش دانشگاهی , مبحث اسید و باز و الکترو شیمی
به همراه نکات مهم و تستی
کاری از مهندس محمد ایراندوست
اختصاصی سایت کنکور

نام فایل : جزوه شیمی پیش دانشگاهی , مبحث اسید و باز
حجم : ۲ مگابایت
دانلود : لینک مستقیم | پرشین گیگ
رمز فایل : www.konkur.in
منبع : سایت کنکور
برچسبها: جزوات کنکوری و نکات تستی شیمی
مطالب بیشتر از سایت ما
دانلود ساختار لوویس مولکولهای مهم برای کنکور جزوات کنکوری و نکات تستی شیمی
دانلود جزوه شیمی پیش دانشگاهی , مبحث محاسبه PH جزوات کنکوری و نکات تستی شیمی
پیونداتم ها جزوات کنکوری و نکات تستی شیمی
نمونه سوال شیمی2 سال91 از نصرت الله بهزادی سوالات امتحانی شیمی
دانلود سوالات تخصصی دکترای سراسری 92 رشته شیمی تجزیه سوالات امتحانی شیمی
مسابقه علمی دبیران شیمی سوالات امتحانی شیمی
نمونه سئوالات شیمی دی ماه 91 مشهد سوالات امتحانی شیمی
نمونه سوالات امتحانی شیمی 1 سال4 سوالات امتحانی شیمی
سوالات نهایی شیمی 3 دی ماه 91 به همرا پاسخنامه سوالات امتحانی شیمی
6 سوال محاسباتی درباره انرژی آزاد گیبس و خود به خودی بودن واکنش های شیمیایی سوالات امتحانی شیمی
دانلود ساختار لوویس مولکولهای مهم برای کنکور جزوات کنکوری و نکات تستی شیمی
جزوات کنکوری و نکات تستی شیمی,دانلود ساختار لوویس مولکولهای مهم برای کنکور
دانلود ساختار لوویس مولکولهای مهم برای کنکور جزوات کنکوری و نکات تستی شیمی
سعی کرده ایم تمام مولکول های مهم که در سالهای اخیر در کتب درسی بوده و نیز در کنکورهای سراسری و آزاد مورد سوال قرارگرفته اند، در این پی دی اف جمع آوری نماییم . ساختار لوویس این مولکول ها رسم شده است و در مواردی که احتمال سوال آمدن در کنکور را دارا هستند ، شکل هندسی و اندازه زوایای پیوندی آن ها را نیز مشخص نموده ایم . همچنین در برخی موارد مهم ، قطبی یا ناقطبی بودن مولکول ها را نیز تعیین کرده ایم.
سعی کرده ایم تمام مولکول های مهم که در سالهای اخیر در کتب درسی بوده و نیز در کنکورهای سراسری و آزاد مورد سوال قرارگرفته اند، در این پی دی اف جمع آوری نماییم . ساختار لوویس این مولکول ها رسم شده است و در مواردی که احتمال سوال آمدن در کنکور را دارا هستند ، شکل هندسی و اندازه زوایای پیوندی آن ها را نیز مشخص نموده ایم . همچنین در برخی موارد مهم ، قطبی یا ناقطبی بودن مولکول ها را نیز تعیین کرده ایم.
کاری از انتشارات مهر و ماه

نام فایل : ساختار لوویس مولکولهای مهم برای کنکور
حجم : ۳۷۸ کیلوبایت
دانلود : لینک مستقیم | پرشین گیگ
رمز فایل : www.konkur.in
منبع : سایت کنکور
برچسبها: جزوات کنکوری و نکات تستی شیمی
مطالب بیشتر از سایت ما
دانلود جزوه شیمی پیش دانشگاهی , مبحث محاسبه PH جزوات کنکوری و نکات تستی شیمی
پیونداتم ها جزوات کنکوری و نکات تستی شیمی
نمونه سوال شیمی2 سال91 از نصرت الله بهزادی سوالات امتحانی شیمی
دانلود سوالات تخصصی دکترای سراسری 92 رشته شیمی تجزیه سوالات امتحانی شیمی
مسابقه علمی دبیران شیمی سوالات امتحانی شیمی
نمونه سئوالات شیمی دی ماه 91 مشهد سوالات امتحانی شیمی
نمونه سوالات امتحانی شیمی 1 سال4 سوالات امتحانی شیمی
سوالات نهایی شیمی 3 دی ماه 91 به همرا پاسخنامه سوالات امتحانی شیمی
6 سوال محاسباتی درباره انرژی آزاد گیبس و خود به خودی بودن واکنش های شیمیایی سوالات امتحانی شیمی
دانلود جزوه شیمی پیش دانشگاهی , مبحث محاسبه PH جزوات کنکوری و نکات تستی شیمی
مبحث محاسبه PH,جزوات کنکوری و نکات تستی شیمی,دانلود جزوه شیمی پیش دانشگاهی
دانلود جزوه شیمی پیش دانشگاهی , مبحث محاسبه PH جزوات کنکوری و نکات تستی شیمی
دانلود جزوه شیمی پیش دانشگاهی , مبحث محاسبه PH
دانلود جزوه شیمی پیش دانشگاهی , مبحث محاسبه PH
کاری از مهندس محمد ایراندوست
اختصاصی سایت کنکور

دانلود جزوه شیمی پیش دانشگاهی , مبحث محاسبه PH
حجم : ۷۱۸ کیلوبایت
دانلود : لینک مستقیم | پرشین گیگ
رمز فایل : www.konkur.in
منبع : سایت کنکور
برچسبها: جزوات کنکوری و نکات تستی شیمی
مطالب بیشتر از سایت ما
پیونداتم ها جزوات کنکوری و نکات تستی شیمی
نمونه سوال شیمی2 سال91 از نصرت الله بهزادی سوالات امتحانی شیمی
دانلود سوالات تخصصی دکترای سراسری 92 رشته شیمی تجزیه سوالات امتحانی شیمی
مسابقه علمی دبیران شیمی سوالات امتحانی شیمی
نمونه سئوالات شیمی دی ماه 91 مشهد سوالات امتحانی شیمی
نمونه سوالات امتحانی شیمی 1 سال4 سوالات امتحانی شیمی
سوالات نهایی شیمی 3 دی ماه 91 به همرا پاسخنامه سوالات امتحانی شیمی
6 سوال محاسباتی درباره انرژی آزاد گیبس و خود به خودی بودن واکنش های شیمیایی سوالات امتحانی شیمی
پیونداتم ها جزوات کنکوری و نکات تستی شیمی
جزوات کنکوری و نکات تستی شیمی,پیونداتم ها
پیونداتم ها جزوات کنکوری و نکات تستی شیمی
بررسی مواد ساده و مرکب در طبیعت نشان میدهد که اکثریت قریب به اتفاق اتمها در طبیعت به حالت آزاد وجود ندارند. مواد سادهای که در طبیعت به حالت آزاد وجود دارند، بندرت بصورت مولکول تک اتمیهستند. بیشتر مواد ساده بصورت مولکولهای دو یا چند اتمی در طبیعت پیدا میشوند. برای مثال گاز هیدروژنی که از اثر اسیدها بر فلزها یا از تجزیه الکتریکی آب یا از هر راه دیگری بدست میآید، بصورت مولکول دو اتمی است.اکسیژن نیز در اغلب موارد بصورت مولکول دو اتمی و گاهی نیز بصورت مولکول سه اتمی اوزون یافت میشود. فسفر سفید بصورت مولکول چهار اتمی و گوگرد بصورت مولکول هشت اتمی است. تنها گازهای بیاثر در طبیعت بصورت تک اتمی یافت میشوند. پیوند شیمیایی در هیدروژن وقتی دو اتم هیدروژن به یکدیگر نزدیک میشوند، اوربیتالهای اتمی آنها به یک اوربیتال مولکولی تبدیل میشود. در اوربیتال مولکولی ابر الکترونی تحت تاثیر جاذبه دو هسته قرار دارد. در حالی که در اوربیتال اتمی ابر الکترونی تحت تاثیر جاذبه یک هسته است.چون نیروی جاذبه هستهها در فضای بین دو هسته از جاهای دیگر بیشتر است، در نتیجه تراکم ابر الکترونی در فاصله دو هسته از جاهای دیگر بیشتر خواهد بود. انرژی پیوند انرژی پیوند، عبارت است از مقدار انرژی آزاد شده به هنگام تشکیل پیوند بین یک مول اتمهای گازی شکل یک عنصر با یک مول اتمهای گازی شکل همان عنصر یا عنصر دیگر. انواع پیوند شیمیایی پیوند کووالانسی در مولکول هیدروژن ، اتمها ، الکترون به اشتراک میگذارند و با استفاده از مدل بور ، الکترونهای مشترک بر روی مدار خارجی هر دو اتم گردش میکنند. به بیان دیگر ، ابر الکترونی تحت تاثیر جاذبه دو هسته قرار دارد و تراکم ابر الکترونی در فاصله دو هسته از جاهای دیگر بیشتر است. چنین پیوندی پیوند کووالانسی نامیده میشود.پیوند کووالانسی بین دو اتم هیدروژن از همپوشانی اوربیتال s بوجود میآید و مولکول حاصل بیضوی است که هستههای دو اتم در دو کانون آن قرار دارند و تراکم ابر الکترونی در بین دو هسته زیاد و در اطراف هستهها کمتر است. در نتیجه تشکیل پیوند ، اوربیتالهای اتمی به اوربیتال مولکولی تبدیل میشوند. اوربیتالهای مولکولی حاصل از تشکیل پیوند میان دو اتم هیدروژن بیضوی است که تراکم ابر الکترونی بر روی خط واصل بین هستههای آن از جاهای دیگر بیشتر است. این شکل اوربیتال مولکولی اوربیتال مولکولی سیگما یا پیوند سیگما نامیده میشود.در نوع دیگر از اوربیتالهای مولکولی ، نه تنها سطح انرژی پائین نمیآید و انرژی آزاد نمیشود، بلکه سطح انرژی از اتمهای اولیه نیز بالاتر است، این اوربیتال را نمیتوان اوربیتال پیوندی نامید، بلکه یک اوربیتالیضد پیوندی است و بصورت نشان داده میشود.هرچه در یک مولکول ، تعداد اوربیتالهای پیوندی اشغال شده بیشتر باشد، مولکول پایدارتر است، ولی هر گاه تعداد اوربیتالهای پیوندی و ضد پیوندی برابر باشد، دو اتم از یکدیگر جدا میمانند و بین آنها پیوندی تشکیل نمیشود. تعداد پیوند میان دو اتم برابر نصف تعداد الکترونهای موجود در اوربیتالهای پیوندی منهای نصف تعداد الکترونهای موجود در اوربیتالهای ضد پیوندی است. پیوند اکسیژن با هیدروژن :اکسیژن ، دو اوربیتال تک الکترونی دارد. هر گاه یک اتم اکسیژن و یک اتم هیدروژن به یکدیگر نزدیک شوند، امکان جاذبه بر دافعه وجود دارد و در این صورت پیوند تشکیل میشود. در این مجموعه ، هیدروژن به آرایش گاز بیاثر هلیم رسیده است، ولی اکسیژن در خارجیترین سطح انرژی خود دارای هفت الکترون شده و هنوز به آرایش گاز بیاثر نرسیده است.آرایش الکترونی اکسیژن پس از تشکیل یک پیوند با یک هیدروژن مشابه آرایش الکترونی فلوئور شده است. بنابراین این مجموعه میتواند به همان راههایی که فلوئور آرایش الکترونی خود را به آرایش الکترونی گاز بیاثر رساند، آرایش الکترونی خود را کامل کند. یکی از راههای رسیدن به آرایش الکترونی گاز بیاثر آن است که با یک اتم هیدروژن دیگر پیوند برقرار کند و مولکول O را پدید آورد. پیوند داتیو اتم نیتروژن با سه اتم هیدروژن ، پیوند کووالانسی معمولی تشکیل میدهد و به آرایش الکترونی گاز بیاثر میرسد. پس از این عمل ، برای نیتروژن یک جفت الکترون غیر پیوندی باقی میماند که میتواند آن را بصورت داتیو در اختیار اتمهایی که به آن نیاز دارند، قرار دهد. از سوی دیگر ، اتم هیدروژن که یک اتم الکترون در اوربیتال آن موجود است، هر گاه این الکترون را از دست بدهد، به یون تبدیل میشود که اوربیتال آن خالی است.حال هرگاه این یون به مولکول آمونیاک نزدیک شود، با آن پیوند داتیو برقرار میکند و خود را به آرایش الکترونی گاز بیاثر میرساند: این مجموعه که یون آمونیوم نامیده میشود، در بسیاری از ترکیبات مانند کلرید آمونیوم و هیدروکسید آمونیوم وجود دارد.اندازه گیریهای انجام شده نشان میدهد که انرژی و طول هر چهار پیوند نیتروژن _ هیدروژن در یون آمونیوم کاملا یکسان است. این امر منطقی نیز به نظر میرسد، زیرا پیوند داتیو نیز مانند پیوند کووالانسی معمولی یک جفت الکترون است که بین هسته اتم نیتروژن و هسته اتم هیدروژن قرار گرفته است. پیوند الکترووالانسی (یونی) در اتم لیتیم ، 2 الکترون وجود دارد که یک الکترون ، در لایه والانس آن قرار دارد. به هنگام تشکیل پیوند ، چون این اتم در دومین سطح انرژی دارای جفت الکترون غیر پیوندی نیست و تفاوت سطح انرژی اول و دوم نیز بسیار زیاد است، نمیتواند الکترون خود را برانگیخته کند. بنابراین در خارجیترین سطح انرژی ، تنها یک الکترون خواهد داشت. هرگاه این اتم بخواهد پیوند کووالانسی تشکیل دهد، باید یک اتم تک الکترونی دیگر مانند فلوئور پیوند تشکیل دهد و را تولید کند.واقعیت آن است که از پیوند بین لیتیم و فلوئور ، فلورید لیتیم پدید میآید، ولی هرگاه بخواهیم این دو اتم را از نظر آرایش الکترونی بررسی کنیم، مشاهده خواهیم کرد که اتم فلوئور با اشتراک گذاشتن الکترون ، ممکن است به آرایش الکترونی گاز بیاثر برسد، ولی لیتیم آرایش الکترونی گاز بیاثر پیدا نکرده است.لیتیم هر گاه بخواهد به آرایش الکترونی گاز بیاثر بعد از خود برسد، باید روی هم رفته هفت الکترون بگیرد که اگر بخواهد این هفت الکترون را با پیوند کووالانسی بدست آورد، خود نیز باید هفت الکترون در خارجیترین سطح انرژی خود داشته باشد که این کار به هیچ وجه امکان پذیر نیست.ولی هر گاه این عنصر بخواهد آرایش الکترونی گاز بیاثر قبل خود را پیدا کند، کافی است که یک الکترون موجود در اوربیتال خود را از دست بدهد تا آرایش الکترونی آن به صورت در آید و آرایش الکترونی گاز بیاثر هلیم پیدا کند. یعنی اتم لیتیم به یون تبدیل میشود و به آرایش گاز هلیم میرسد.اتم فلوئور نیز میتواند با گرفتن یک الکترون و تبدیل شدن به یون خود را به آرایش الکترونی گاز بی اثر نئون برساند. یعنی به هنگام تشکیل پیوند بین لیتیم و فلوئور ، لیتیم یک الکترون به فلوئور میدهد و با این عمل هر دو به آرایش الکترونی گاز بیاثر میرسند. به این ترتیب اتم فلوئور به یون منفی (آنیون) و اتم لیتیم به یون مثبت (کاتیون) تبدیل میشود. این نوع پیوند را پیوند الکترووالانسی یا یونی مینامند که بین یک فلز و یک غیرفلز رخ میدهد.
بررسی مواد ساده و مرکب در طبیعت نشان میدهد که اکثریت قریب به
اتفاق اتمها در طبیعت به حالت آزاد وجود ندارند. مواد سادهای که در طبیعت
به حالت آزاد وجود دارند، بندرت بصورت مولکول تک اتمیهستند. بیشتر مواد
ساده بصورت مولکولهای دو یا چند اتمی در طبیعت پیدا میشوند. برای مثال
گاز هیدروژنی که از اثر اسیدها بر فلزها یا از تجزیه الکتریکی آب یا از هر راه دیگری بدست میآید، بصورت مولکول دو اتمی 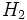 است.
است.
اکسیژن نیز در اغلب موارد بصورت مولکول دو اتمی 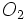 و گاهی نیز بصورت مولکول سه اتمی اوزون
و گاهی نیز بصورت مولکول سه اتمی اوزون 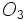 یافت میشود. فسفر سفید بصورت مولکول چهار اتمی
یافت میشود. فسفر سفید بصورت مولکول چهار اتمی 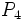 و گوگرد بصورت مولکول هشت اتمی
و گوگرد بصورت مولکول هشت اتمی  است. تنها گازهای بیاثر در طبیعت بصورت تک اتمی یافت میشوند.
است. تنها گازهای بیاثر در طبیعت بصورت تک اتمی یافت میشوند.
پیوند شیمیایی در هیدروژن
وقتی دو اتم هیدروژن به یکدیگر نزدیک
میشوند، اوربیتالهای اتمی آنها به یک اوربیتال مولکولی تبدیل میشود. در
اوربیتال مولکولی ابر الکترونی تحت تاثیر جاذبه دو هسته قرار دارد. در حالی
که در اوربیتال اتمی ابر الکترونی تحت تاثیر جاذبه یک هسته است.
چون
نیروی جاذبه هستهها در فضای بین دو هسته از جاهای دیگر بیشتر است، در
نتیجه تراکم ابر الکترونی در فاصله دو هسته از جاهای دیگر بیشتر خواهد بود.
انرژی پیوند
انرژی پیوند، عبارت است از مقدار انرژی آزاد شده به
هنگام تشکیل پیوند بین یک مول اتمهای گازی شکل یک عنصر با یک مول اتمهای
گازی شکل همان عنصر یا عنصر دیگر.
انواع پیوند شیمیایی
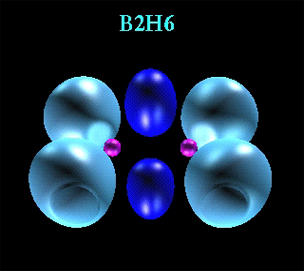
پیوند کووالانسی
در مولکول هیدروژن ، اتمها ، الکترون به اشتراک میگذارند و با استفاده از مدل بور
، الکترونهای مشترک بر روی مدار خارجی هر دو اتم گردش میکنند. به بیان
دیگر ، ابر الکترونی تحت تاثیر جاذبه دو هسته قرار دارد و تراکم ابر
الکترونی در فاصله دو هسته از جاهای دیگر بیشتر است. چنین پیوندی پیوند کووالانسی نامیده میشود.
پیوند
کووالانسی بین دو اتم هیدروژن از همپوشانی اوربیتال s بوجود میآید و
مولکول حاصل بیضوی است که هستههای دو اتم در دو کانون آن قرار دارند و
تراکم ابر الکترونی در بین دو هسته زیاد و در اطراف هستهها کمتر است. در
نتیجه تشکیل پیوند ، اوربیتالهای اتمی به اوربیتال مولکولی تبدیل میشوند.
اوربیتالهای مولکولی حاصل از تشکیل پیوند میان دو اتم هیدروژن بیضوی است که
تراکم ابر الکترونی بر روی خط واصل بین هستههای آن از جاهای دیگر بیشتر
است. این شکل اوربیتال مولکولی اوربیتال مولکولی سیگما یا پیوند سیگما نامیده میشود.
در
نوع دیگر از اوربیتالهای مولکولی ، نه تنها سطح انرژی پائین نمیآید و
انرژی آزاد نمیشود، بلکه سطح انرژی از اتمهای اولیه نیز بالاتر است، این
اوربیتال را نمیتوان اوربیتال پیوندی نامید، بلکه یک اوربیتالیضد پیوندی
است و بصورت  نشان داده میشود.
نشان داده میشود.
هرچه
در یک مولکول ، تعداد اوربیتالهای پیوندی اشغال شده بیشتر باشد، مولکول
پایدارتر است، ولی هر گاه تعداد اوربیتالهای پیوندی و ضد پیوندی برابر
باشد، دو اتم از یکدیگر جدا میمانند و بین آنها پیوندی تشکیل نمیشود.
تعداد پیوند میان دو اتم برابر نصف تعداد الکترونهای موجود در اوربیتالهای
پیوندی منهای نصف تعداد الکترونهای موجود در اوربیتالهای ضد پیوندی است.
اکسیژن ، دو اوربیتال تک
الکترونی دارد. هر گاه یک اتم اکسیژن و یک اتم هیدروژن به یکدیگر نزدیک
شوند، امکان جاذبه بر دافعه وجود دارد و در این صورت پیوند تشکیل میشود.
در این مجموعه ، هیدروژن به آرایش گاز بیاثر هلیم رسیده است، ولی اکسیژن
در خارجیترین سطح انرژی خود دارای هفت الکترون شده و هنوز به آرایش گاز
بیاثر نرسیده است.
آرایش الکترونی اکسیژن پس از تشکیل یک پیوند با
یک هیدروژن مشابه آرایش الکترونی فلوئور شده است. بنابراین این مجموعه
میتواند به همان راههایی که فلوئور آرایش الکترونی خود را به آرایش
الکترونی گاز بیاثر رساند، آرایش الکترونی خود را کامل کند. یکی از راههای
رسیدن به آرایش الکترونی گاز بیاثر آن است که با یک اتم هیدروژن دیگر
پیوند برقرار کند و مولکول  O را پدید آورد.
O را پدید آورد. پیوند داتیو
اتم نیتروژن با سه اتم هیدروژن ، پیوند کووالانسی
معمولی تشکیل میدهد و به آرایش الکترونی گاز بیاثر میرسد. پس از این عمل
، برای نیتروژن یک جفت الکترون غیر پیوندی باقی میماند که میتواند آن را
بصورت داتیو در اختیار اتمهایی که به آن نیاز دارند، قرار دهد. از سوی
دیگر ، اتم هیدروژن که یک اتم الکترون در اوربیتال  آن موجود است، هر گاه این الکترون را از دست بدهد، به یون
آن موجود است، هر گاه این الکترون را از دست بدهد، به یون 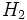 تبدیل میشود که اوربیتال
تبدیل میشود که اوربیتال 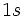 آن خالی است.
آن خالی است.
حال هرگاه این یون به مولکول آمونیاک نزدیک شود، با آن پیوند داتیو برقرار میکند و خود را به آرایش الکترونی گاز بیاثر میرساند: 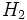 این مجموعه که یون آمونیوم نامیده میشود، در بسیاری از ترکیبات مانند کلرید آمونیوم
این مجموعه که یون آمونیوم نامیده میشود، در بسیاری از ترکیبات مانند کلرید آمونیوم 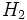 و هیدروکسید آمونیوم
و هیدروکسید آمونیوم 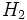 وجود دارد.
وجود دارد.
اندازه گیریهای انجام شده نشان میدهد که انرژی و طول هر چهار پیوند نیتروژن _ هیدروژن
در یون آمونیوم کاملا یکسان است. این امر منطقی نیز به نظر میرسد، زیرا
پیوند داتیو نیز مانند پیوند کووالانسی معمولی یک جفت الکترون است که بین
هسته اتم نیتروژن و هسته اتم هیدروژن قرار گرفته است.
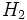
پیوند الکترووالانسی (یونی)
در اتم لیتیم ، 2 الکترون وجود دارد
که یک الکترون ، در لایه والانس آن قرار دارد. به هنگام تشکیل پیوند ، چون
این اتم در دومین سطح انرژی دارای جفت الکترون غیر پیوندی نیست و تفاوت سطح
انرژی اول و دوم نیز بسیار زیاد است، نمیتواند الکترون خود را برانگیخته
کند. بنابراین در خارجیترین سطح انرژی ، تنها یک الکترون خواهد داشت.
هرگاه این اتم بخواهد پیوند کووالانسی تشکیل دهد، باید یک اتم تک الکترونی
دیگر مانند فلوئور پیوند تشکیل دهد و 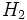 را تولید کند.
را تولید کند.
واقعیت آن است که از پیوند بین لیتیم و فلوئور ، فلورید لیتیم 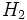 پدید میآید، ولی هرگاه بخواهیم این دو اتم را از نظر آرایش الکترونی
بررسی کنیم، مشاهده خواهیم کرد که اتم فلوئور با اشتراک گذاشتن الکترون ،
ممکن است به آرایش الکترونی گاز بیاثر برسد، ولی لیتیم آرایش الکترونی گاز
بیاثر پیدا نکرده است.
پدید میآید، ولی هرگاه بخواهیم این دو اتم را از نظر آرایش الکترونی
بررسی کنیم، مشاهده خواهیم کرد که اتم فلوئور با اشتراک گذاشتن الکترون ،
ممکن است به آرایش الکترونی گاز بیاثر برسد، ولی لیتیم آرایش الکترونی گاز
بیاثر پیدا نکرده است.
لیتیم هر گاه بخواهد به آرایش الکترونی گاز
بیاثر بعد از خود برسد، باید روی هم رفته هفت الکترون بگیرد که اگر
بخواهد این هفت الکترون را با پیوند کووالانسی بدست آورد، خود نیز باید هفت
الکترون در خارجیترین سطح انرژی خود داشته باشد که این کار به هیچ وجه
امکان پذیر نیست.
ولی هر گاه این عنصر بخواهد آرایش الکترونی گاز بیاثر قبل خود را پیدا کند، کافی است که یک الکترون موجود در اوربیتال 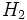 خود را از دست بدهد تا آرایش الکترونی آن به صورت
خود را از دست بدهد تا آرایش الکترونی آن به صورت 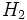 در آید و آرایش الکترونی گاز بیاثر هلیم پیدا کند. یعنی اتم لیتیم به یون
در آید و آرایش الکترونی گاز بیاثر هلیم پیدا کند. یعنی اتم لیتیم به یون 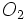 تبدیل میشود و به آرایش گاز هلیم میرسد.
تبدیل میشود و به آرایش گاز هلیم میرسد.
اتم فلوئور نیز میتواند با گرفتن یک الکترون و تبدیل شدن به یون 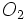 خود را به آرایش الکترونی گاز بی اثر نئون برساند. یعنی به هنگام تشکیل
پیوند بین لیتیم و فلوئور ، لیتیم یک الکترون به فلوئور میدهد و با این
عمل هر دو به آرایش الکترونی گاز بیاثر میرسند. به این ترتیب اتم فلوئور
به یون منفی (آنیون) و اتم لیتیم به یون مثبت (کاتیون) تبدیل میشود. این
نوع پیوند را پیوند الکترووالانسی یا یونی مینامند که بین یک فلز و یک غیرفلز رخ میدهد.
خود را به آرایش الکترونی گاز بی اثر نئون برساند. یعنی به هنگام تشکیل
پیوند بین لیتیم و فلوئور ، لیتیم یک الکترون به فلوئور میدهد و با این
عمل هر دو به آرایش الکترونی گاز بیاثر میرسند. به این ترتیب اتم فلوئور
به یون منفی (آنیون) و اتم لیتیم به یون مثبت (کاتیون) تبدیل میشود. این
نوع پیوند را پیوند الکترووالانسی یا یونی مینامند که بین یک فلز و یک غیرفلز رخ میدهد.
برچسبها: جزوات کنکوری و نکات تستی شیمی
مطالب بیشتر از سایت ما
نمونه سوال شیمی2 سال91 از نصرت الله بهزادی سوالات امتحانی شیمی
دانلود سوالات تخصصی دکترای سراسری 92 رشته شیمی تجزیه سوالات امتحانی شیمی
مسابقه علمی دبیران شیمی سوالات امتحانی شیمی
نمونه سئوالات شیمی دی ماه 91 مشهد سوالات امتحانی شیمی
نمونه سوالات امتحانی شیمی 1 سال4 سوالات امتحانی شیمی
سوالات نهایی شیمی 3 دی ماه 91 به همرا پاسخنامه سوالات امتحانی شیمی
6 سوال محاسباتی درباره انرژی آزاد گیبس و خود به خودی بودن واکنش های شیمیایی سوالات امتحانی شیمی
نمونه سوالات امتحانی نمونه سوالات امتحانی
دانلود جزوه شیمی سال سوم دبیرستان ، استوکیومتری ، فصل اول جزوات کنکوری و نکات تستی شیمی
جزوات کنکوری و نکات تستی شیمی,دانلود جزوه شیمی سال سوم دبیرستان ، استوکیومتری ، فصل اول
دانلود جزوه شیمی سال سوم دبیرستان ، استوکیومتری ، فصل اول جزوات کنکوری و نکات تستی شیمی
دانلود جزوه شیمی سال سوم دبیرستان ، استوکیومتری ، فصل اول
دانلود جزوه شیمی سال سوم دبیرستان ، استوکیومتری ، فصل اول
جزوه ای از مهندس فرشاد میرزایی
اختصاصی سایت کنکور

دانلود جزوه شیمی سال سوم دبیرستان ، استوکیومتری ، فصل اول
حجم : ۹۰۱ کیلوبایت
دانلود : لینک مستقیم | پرشین گیگ
رمز فایل : www.konkur.in
منبع : سایت کنکور
برچسبها: جزوات کنکوری و نکات تستی شیمی
مطالب بیشتر از سایت ما
دانلود جزوه شیمی ۲ , فصل چهارم به صورت کامل جزوات کنکوری و نکات تستی شیمی
دانلود جزوه شیمی سال سوم , مبحث غلظت جزوات کنکوری و نکات تستی شیمی
دانلود جزوه شیمی ۲ , فصل چهارم بخش دوم جزوات کنکوری و نکات تستی شیمی
دانلود جزوه کامل آموزشی و کنکوری شیمی ۲ جزوات کنکوری و نکات تستی شیمی
دانلود جزوه شیمی سال چهارم ،فصل الکتروشیمی جزوات کنکوری و نکات تستی شیمی
خلاصه نویسی شیمی سال دوم فصل ۲ و ۳ ( دست نویس ) جزوات کنکوری و نکات تستی شیمی
دانلود جزوه شیمی دو , فصل ۴ پیوند کووالانسی جزوات کنکوری و نکات تستی شیمی
دانلود جزوه شیمی ۲ , فصل چهارم جزوات کنکوری و نکات تستی شیمی
خلاصه نویسی شیمی سال دوم فصل ۱ و ۲ ( دست نویس ) جزوات کنکوری و نکات تستی شیمی